전기 회로의 핵심 요소: 양극과 음극
전기화학 및 전자 회로에서 “양극”과 “음극”은 매우 기본적인 용어입니다. 이 두 가지 종류의 전극은 단순한 배터리부터 고도의 기술 시스템까지 다양한 분야에서 중요한 역할을 수행합니다.
이제 이 둘의 차이점, 긍정과 부정의 의미, 그리고 어떤 전극이 양극인지 음극인지 쉽게 구별하는 방법을 자세히 알아보겠습니다.
전극이란 무엇인가?
양극과 음극에 대해 깊이 들어가기 전에, 먼저 전극의 기본적인 개념을 이해하는 것이 중요합니다. 전극이란, 간단히 말해 전류가 전해 전지와 같은 비금속 매체를 드나들 수 있도록 전기 전도를 돕는 물질입니다.
좀 더 쉽게 설명하자면, 전극은 회로에서 비금속 요소와 전기적으로 접촉하는 도체 역할을 합니다.
양극이란 무엇인가?

전극이 양극인지 음극인지는 회로의 유형에 따라 결정됩니다. 양극은 산화 반응이 일어나는 전극으로, 전자를 잃는 과정이 발생합니다. 화학 에너지를 전기로 변환하는 갈바니 전지(예: 배터리 방전)의 경우, 양극은 산화 과정에서 전자를 잃고 외부 회로를 통해 전자가 흐르기 때문에 음극의 역할을 합니다.
반대로, 전류가 전자의 흐름을 반대 방향으로 유도하는 전기 분해 과정에서는 양극이 양극으로 작용합니다.
음극이란 무엇인가?
 이미지 출처: 라즈베리 파이
이미지 출처: 라즈베리 파이
음극은 환원 반응이 일어나는 장소이며, 전자를 얻는 과정을 촉진합니다. 갈바니 전지에서 이온은 전극으로부터 전자를 얻어 환원되고, 이 과정에서 도금이 일어날 수 있기 때문에 음극은 양극으로 작용합니다.
반면, 전기 분해에서 음극은 음극 단자 역할을 하며, 용액 내의 양이온을 끌어당깁니다.
양극 대 음극: 극성 명확히 하기
과거에는 전기가 양극에서 음극으로 흐른다고 믿었지만, 실제로는 그 반대입니다. 이러한 초기 오해로 인해 일부 사람들은 양극을 음의 극성, 음극을 양의 극성과 연결시키기도 했습니다.
그러나 각 전극의 산화 및 환원 역할을 정확히 이해한다면, 어떤 전극이 양극인지 음극인지 회로의 유형에 따라 쉽게 판단할 수 있습니다.
배터리에서 전해질이란 무엇인가?
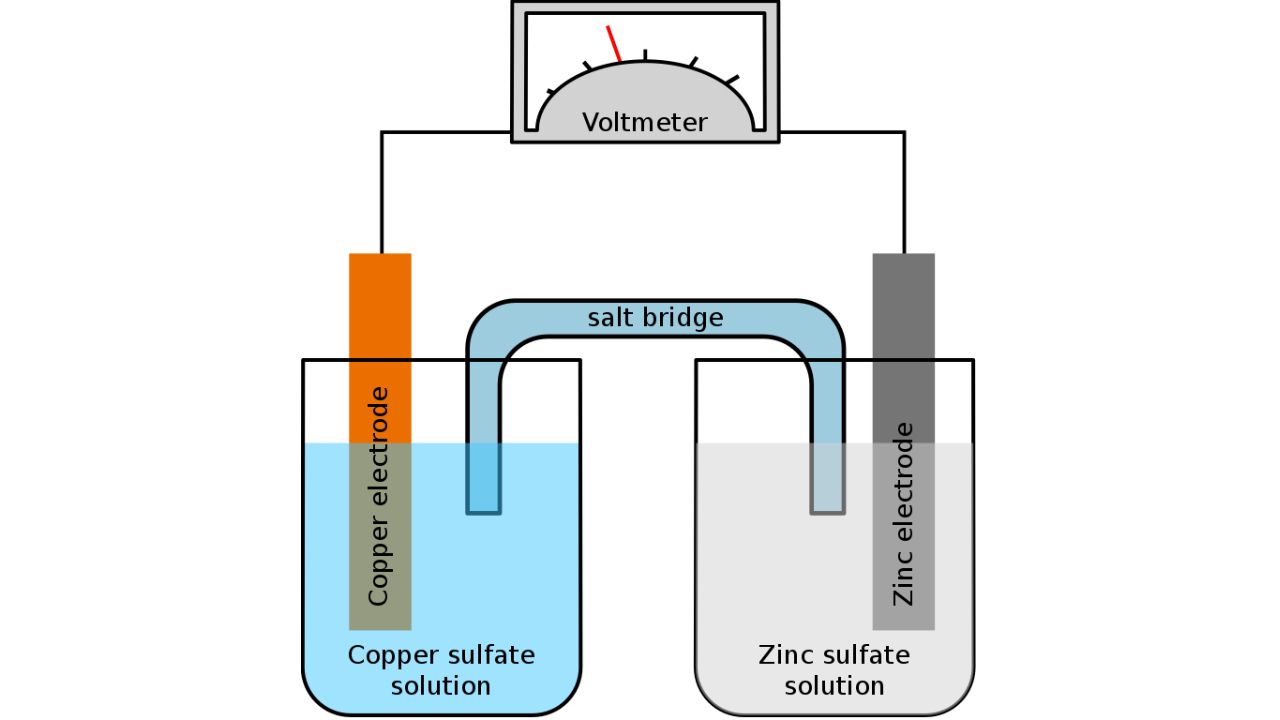 이미지 제공: Tinux/gringer/위키미디어 공용
이미지 제공: Tinux/gringer/위키미디어 공용
배터리에서 전해질은 전기적으로 중성을 유지하면서 양극과 음극 사이에서 이온의 흐름을 가능하게 하는 매개체를 의미합니다. 이러한 이온 이동은 충전 및 방전 과정에서 일어나는 화학 반응에 필수적입니다. 이와 관련된 더 자세한 내용은 리튬 이온 EV 배터리 작동 방식에 대한 글을 참고하시기 바랍니다.
어느 것이 양극인가?
셀 또는 회로의 전극에 대해 논할 때, 극성을 이해하려면 양쪽 전극에서 발생하는 두 가지 반응을 고려하는 것이 중요합니다. 갈바니 전지에서는 양극이 산화되어 음극으로 작용하며, 전기 분해에서는 양극으로 기능합니다. 반대로, 음극은 환원을 촉진하며 갈바니 전지에서는 양극으로 작동하지만, 전기 분해에서는 음극 단자 역할을 합니다.